Cálculos químicos: Concentração de soluções

CHUÁÁÁ… A água é um solvente universal – nela se dissolve quase tudo. Os peixes, por exemplo, dependem do oxigênio dissolvido nos mares e rios
A solubilidade de uma solução depende de reações entre as moléculas do solvente e dos solutos
Recordando: as misturas podem ser homogêneas ou heterogêneas, dependendo do número de fases que apresentam. Com uma única fase, homogênea; com mais de uma, heterogênea. As misturas homogêneas também são chamadas de soluções, e seus componentes, de solutos e solventes. O soluto é aquele cujas partículas se distribuem homogeneamente pelo solvente no processo da dissolução. A concentração de uma solução indica a quantidade de soluto distribuída numa solução.
Dissolução
Para que um soluto se dissolva num solvente, é preciso que suas partículas (moléculas ou íons) interajam. Veja o que ocorre quando se dissolve sal de cozinha em água:
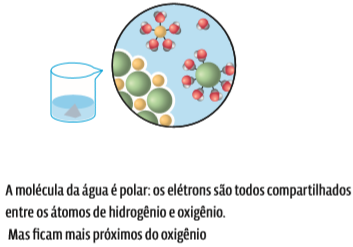
A água é um composto molecular. Os átomos que formam a molécula da água, o hidrogênio (H) e o oxigênio (O), têm diferentes graus de eletronegatividade: o átomo O é muito eletronegativo (tem grande poder de atrair elétrons), enquanto o átomo H é pouco eletronegativo (menor poder de atração). Na molécula, o átomo O e os dois átomos H estão ligados – ou seja, compartilham elétrons. Se o átomo O atrai os elétrons com maior intensidade, os elétrons ficam mais próximos a esse átomo. Isso cria uma polaridade na molécula. Uma molécula polar é aquela em que os elétrons não estão distribuídos de forma igual entre os átomos. Esse tipo de molécula tem um polo positivo (H, com menos elétrons perto) e um polo negativo (O, com mais elétrons perto).
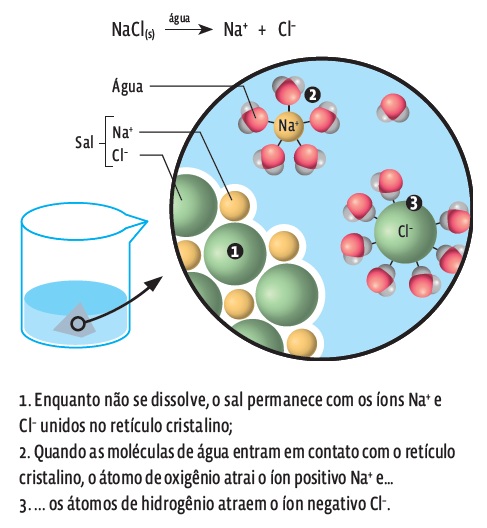
Já o cloreto de sódio (NaCl) é um composto iônico que no estado sólido tem os íons Na+ e Cl– organizados em retículo cristalino. Esse retículo se mantém unido porque os íons se atraem devido a suas cargas opostas.
O cloreto de sódio (NaCl) se dissolve em água porque as moléculas da água (H2O) interagem com os íons do sal (Na+ e Cl–) por meio de seus dois polos: o polo negativo (O) interage com os íons positivos (Na+), e o polo positivo (H) interage com os íons negativos (Cl–). Como resultado desse puxa de cá, puxa de lá, a água consegue separar os íons do sal, intrometendo suas moléculas entre os íons. A solução fica saturada – sobra soluto sem ser dissolvido – quando as moléculas de água não são suficientes para separar os íons do sal.
ADEUS, RETÍCULO
O sal se dissolve quando suas ligações iônicas são quebradas pelas moléculas de água. Acompanhe:
Toda dissolução envolve a interação entre as partículas do soluto e do solvente. Mas atenção: nessa interação não há compartilhamento de elétrons, apenas aproximação. A dissolução por polaridade não ocorre apenas entre moléculas e íons, mas também entre dois tipos de molécula. O açúcar, por exemplo, não é um composto iônico, mas molecular, e também se dissolve em água. Isso porque as moléculas de açúcar, assim como as de água, também são polares. Dessa forma, todas elas interagem.
Se não há interação, a dissolução é mínima ou praticamente não ocorre. O gás oxigênio (O2), por exemplo, dissolve-se muito pouco em água. É que as moléculas formadas por átomos iguais (como O2) não apresentam diferença de eletronegatividade. Por quê? Ora, porque os dois átomos são do mesmo elemento químico. Sem diferença de eletronegatividade não há a formação de polos. Resultado: a solubilidade do oxigênio em água é muito pequena.
A interação entre as partículas não é o único fator que define se uma substância é ou não solúvel em outra. Tanto é que nem todo composto iônico é solúvel em água, mas esses outros fatores não são estudados no Ensino Médio.
Solubilidade
A água tem moléculas que interagem com um imenso número de substâncias. Por isso é chamada solvente universal – o mais importante para o estudo de solubilidade. Esses dados são obtidos experimentalmente, e com eles podemos construir gráficos chamados curvas de solubilidade.
A curva de solubilidade indica a quantidade máxima de uma substância capaz de se dissolver em 100 gramas de água, a uma dada temperatura. Veja o gráfico:
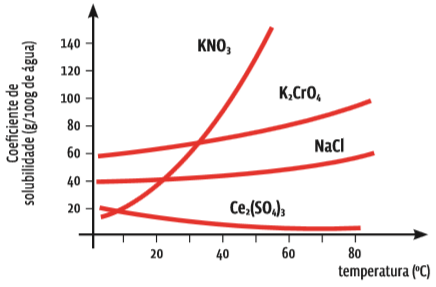
Uns mais, outros menos O gráfico mostra a curva de solubilidade de quatro sais. Repare que o coeficiente de solubilidade é dado em gramas da substância a cada 100 gramas de água. Perceba, também, que, para três desses sais, a solubilidade aumenta conforme a temperatura se eleva – algumas vezes, muito rapidamente, como no caso do sal KNO3. Mas, para um desses sais, o Ce2(SO4)3, quanto mais quente fica a água, mais difícil é sua dissolução.

Alguns autores chamam de solvente a substância que participa da solução em maior quantidade; para outros, solvente é a substância que se encontra no mesmo estado físico da solução, independentemente da quantidade. A água, porém, é sempre considerada solvente. E, quando se fala em solução, sem especificar o solvente, subentende-se solução aquosa.
Concentração
Concentração de uma solução é a quantidade de soluto distribuída numa determinada quantidade de solução. Pela concentração conseguimos determinar quanto do soluto existe em determinado volume ou determinada massa de uma solução. Assim como a solubilidade, a concentração também é uma proporção:

Essas quantidades de soluto e solução podem ser expressas em massa, volume ou em quantidade de matéria.
Concentração comum (g/L)
É uma forma muito usual de expressar a concentração (C) de uma solução. Concentração comum é a relação entre a massa de soluto e o volume da solução:

Uma solução de ácido clorídrico (HCl) com concentração de 30 g/L é uma solução em que para cada litro têm-se 30 g de HCl.

Importante:
concentração de uma solução não é o mesmo que densidade de uma solução. Ambas as medidas são uma relação entre massa e volume. Mas veja a diferença:
- • Concentração é a massa de soluto em uma solução;
- • Densidade é a massa de determinado volume de solução, dada pela expressão:
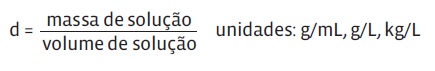
Uma solução de NaCl com densidade 1 .200 g/L e concentração de 120 g/L é uma solução em que:
- • A cada litro de solução existem 120 gramas do soluto NaCl (concentração);
- • Cada litro de solução (solvente + soluto) tem massa de 1.200 g (densidade).
Concentração em quantidade de matéria (mol/L)
É a relação entre a quantidade de matéria (mol) e o volume em litros da solução. Sua representação pode ser dada pela fórmula do soluto entre colchetes ou apenas por um par de colchetes fechado. (Lembre-se de que utilizamos a letra n para representar quantidade de matéria.)

Também podemos utilizar a massa molar para relacionar a concentração comum, em g/L, com a concentração em quantidade de matéria, em mol/L.


Concentração em porcentagem de massa. É a concentração que relaciona massa de soluto por massa de solução (m/m). Geralmente, é dada em porcentagem, ou a massa de soluto contida em 100 gramas e de solução.

Proporções corretas
Em laboratório, para realização de experimentos, os químicos nem sempre utilizam substâncias puras, mas dissolvidas em soluções aquosas. Em solução, a superfície de contato entre os reagentes é maior – o que faz com que a reação ocorra mais rapidamente, e a observação dos fenômenos químicos fica mais fácil. Nesta aula veremos os vários procedimentos realizados em laboratório: desde a preparação, a diluição até a mistura de diversas soluções.
Preparo de uma solução
Qualquer solução antes de começar a ser preparada precisa ter definidos o volume e a concentração. O preparo de 250 mililitros de uma solução de sulfato de níquel [NiSO4] = 0,1 mol/L segue os seguintes passos:
- • Cálculo da quantidade de soluto necessária para a solução:
- • Volume da solução: 250 mL;
- • Concentração: 0,1 mol/L
Sabemos que
[ ] = n/V Então:
n = 0,1 mol/L . 0,25 L
n = 0,025 mol de NiSO4
(Lembre-se de que o volume (V) se refere ao volume da solução, e não apenas da água.)
- • Consultando a tabela periódica, sabemos que 1 mol de NiSO4 tem MM = 155 g/mol.
Então, pela regra de três, descobrimos a massa de 0,025 mol:
1 mol – 155 g
0,025 mol – m g
m = 0,025 . 155 = 3,9 g 1
Temos as medidas exatas da solução a ser preparada: 250 mL de solução com 3,9 g de NiSO4.
Diluição e concentração
Lidamos com o conceito de concentração comumente no dia a dia. Um café forte é aquele em que a água tem alta concentração das substâncias contidas no pó. Um refresco aguado é aquele em que a quantidade de polpa de fruta é pouca em comparação à quantidade de água – ou seja, a polpa está muito diluída. De modo geral, pode-se dizer que:
- • Diluir uma solução significa acrescentar solvente à solução. Isso aumenta o volume final da solução, mas a quantidade de soluto permanece inalterada. Daí, a concentração da solução é menor;
- • Concentrar uma solução significa diminuir a quantidade de solvente. Nesse caso, o volume da solução diminui, mas a quantidade de soluto permanece constante, o que resulta no aumento da concentração. O aumento na concentração pode ser feito pela evaporação do solvente.
Repare que, nos dois processos – de diluição e concentração –, só se altera o volume da solução. A quantidade de soluto permanece constante. Assim, podemos estabelecer algumas relações entre dois momentos de uma mesma solução que sofre um processo de concentração ou diluição. Acompanhe:
- • Considere uma solução com concentração inicial C1 (dada em g/L) e volume inicial V1 (dado em L).
- • Sabemos que a concentração é a massa do soluto dividida pelo volume da solução, então: C1 = m1/V1
- • m1 = C1 . V1
Se a concentração inicial da solução for alterada, teremos: C2 = m2/V2 e, portanto, m2 = C2 . V2, em que C2 é a concentração final e V2, o volume final.
- • Mas sabemos que a massa do soluto não se altera. Se m1 = m2
- • C1 . V1 = C2 . V2
Ou seja, numa solução cuja concentração é aumentada ou diminuída, a concentração e o volume são inversamente proporcionais: se o volume da solução sobe, a concentração desce; se o volume da solução desce, a concentração se eleva.
O raciocínio é válido para concentrações medidas em quantidade de matéria ([ ], em mol/L). A quantidade de matéria não se altera, e a concentração é inversamente proporcional ao volume: [ ]1 . V1 = [ ]2 . V2 07.5

Mistura sem reação
Quando se misturam duas soluções, a concentração e o volume finais dependem do fato de ocorrer, ou não, alguma reação química entre os componentes das soluções misturadas.
Na mistura de soluções em que não há reação química entre os componentes, o volume e a concentração dos solutos na solução final são diferentes dos valores originais.
Se as soluções misturadas (a, b, c…) têm mesmo soluto e mesmo solvente, a quantidade de matéria da solução resultante (nF) é a soma da quantidade de matéria dos solutos das soluções iniciais (nF = na + nb + nc + …).
E o volume final é a soma dos volumes de cada uma das soluções originais: (VF = Va + Vb + Vc + …)
Já para as soluções com solutos diferentes, no caso de misturas sem reação química, apenas o volume se altera – o que, por sua vez, altera a concentração. O raciocínio é claro: a quantidade de matéria permanece a mesma, tanto para a substância A quanto para a substância B. Sobe apenas o volume.

Mistura com reação
Em alguns casos, na mistura de duas soluções, os componentes de uma reagem com os componentes da outra, formando novas substâncias. Para determinar a quantidade final de cada uma dessas substâncias é preciso analisar os cálculos estequiométricos da reação.






















